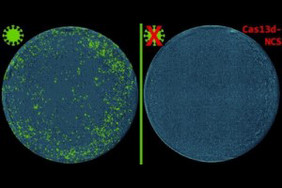
Das Aufkommen von RNA-Viren wie SARS-CoV-2 macht deutlich, dass neue Wege zu ihrer Bekämpfung gefunden werden müssen. RNA-zielgerichtete-Werkzeuge wie CRISPR/Cas13 sind leistungsstark, aber ineffizient im Zytoplasma von Zellen, wo sich viele RNA-Viren replizieren. Forschende vom Helmholtz Munich und der Technischen Universität München (TUM) haben eine Lösung entwickelt: Cas13d-NCS.
CRISPR/Cas13-Systeme sind für ihre programmierbaren Fähigkeiten zur Manipulation von RNAs bekannt und haben sich zu unverzichtbaren Werkzeugen für verschiedene RNA-Targeting-Anwendungen entwickelt. Ein erhebliches Hindernis hat jedoch die Wirksamkeit von Cas13d beeinträchtigt: seine Beschränkung auf den Zellkern von Säugetierzellen. Dies schränkte seinen Nutzen bei zytosolischen Anwendungen, wie z. B. programmierbaren antiviralen Therapien, drastisch ein.
Ein wissenschaftliches Team um Prof. Wolfgang Wurst, Dr. Christoph Gruber und Dr. Florian Giesert (Institut für Entwicklungsgenetik bei Helmholtz Munich und Lehrstuhl für Entwicklungsgenetik an der TUM), welches intensiv mit den Teams von Dr. Gregor Ebert (Institut für Virologie bei Helmholtz Munich und an der TUM) und von Prof. Andreas Pichlmair (Institut für Virologie an der TUM) zusammenarbeitete, hat diese Herausforderung, die mit der zytosolischen Inaktivität von Cas13d verbunden ist, erfolgreich gemeistert.
Das neue molekulare Werkzeug Cas13d-NCS, durch sorgfältiges Screening und Optimierung entwickelt, ermöglicht es CRISPR-RNA-Molekülen (crRNAs), die sich im Zellkern befinden, in das Zytoplasma zu wandern. Die kurzen RNA-Moleküle leiten den CRISPR-Cas-komplex zu bestimmten Zielsequenzen, die die RNA-Viren hochwirksam und mit bisher unerreichter Präzision abbauen und damit neutralisieren.
Mit bemerkenswerter Effizienz übertrifft Cas13d-NCS seine Vorgänger beim Abbau von mRNA-Zielen und bei der Neutralisierung selbstreplizierender RNA, darunter Stämme des RNA-Virus der Venezolanischen Pferdeenzephalitis (VEE) und mehrere Varianten von SARS-CoV-2, und erschließt damit das volle Potenzial von Cas13d als programmierbares antivirales Werkzeug.
Dieser bedeutende Fortschritt ist ein wichtiger Schritt zur Bekämpfung von Pandemien und zur Stärkung des therapeutischen Repertoires gegen künftige Ausbrüche.
Die Ergebnisse wurden in Cell Discovery veröffentlicht: Gruber et al., 2024: Engineered, nucleocytoplasmic shuttling Cas13d enables highly efficient cytosolic RNA targeting. Cell Discovery. DOI: 10.1038/s41421-024-00672-1