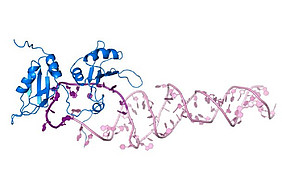
Ein internationales Forscherteam unter der Leitung des Helmholtz Zentrums München, der Technischen Universität München und der Universität Edinburgh konnte die Reifung einer krebsauslösenden mikroRNA in der Genregulation aufklären. Die im Fachmagazin Nature Communications veröffentlichten Daten lassen auf neue Therapien hoffen.
MikroRNAs (miRNAs) sind Moleküle, die aus kurzen Abfolgen von RNA-Bausteinen bestehen. Sie spielen bei der Genregulation eine große Rolle. Indem sie spezifische Abschnitte der Boten-RNA (mRNA) erkennen und abbauen, können sie die Synthese bestimmter Proteinen verhindern.
Auch krebsauslösende miRNAs, sogenannte oncomiRs, arbeiten nach diesem Prinzip und verhindern vor allem die Produktion von Proteinen, die die Zelle vor unkontrolliertem Wachstum schützen. „So führt ein verstärktes Auftreten dieser Moleküle in der Zelle langfristig zur Krebsentstehung“, erklärt Prof. Michael Sattler, Direktor des Instituts für Strukturbiologie am Helmholtz Zentrum München und Lehrstuhlinhaber für Biomolekulare NMR Spektroskopie an der Technischen Universität München. „Allerdings sind die molekularen Mechanismen, wie manche miRNAs in der Zelle überhaupt hergestellt werden bis heute nicht gut verstanden.“
Bevor MikroRNAs jedoch in einer Zelle wirken können, durchlaufen sie mehrere Reifungsschritte und entwickeln sich von einer sogenannten primären pri-miRNA über ein Vorläuferstadium (englisch: precursor, daher pre-miRNA) hin zur reifen miRNA.
Die Reifung einer bestimmten pri-miRNA untersuchte Sattler gemeinsam mit Forschern um Prof. Javier Caceres und Dr. Gracjan Michlewski von der Universität Edinburgh sowie sein Mitarbeiter Hamed Kooshapur (nun National Institutes of Health, USA). Die Wissenschaftler hatten sich dabei auf eine miRNA konzentriert, die im Zusammenhang mit Darm-, Brust- und Speiseröhrenkrebs steht und kombinierten bei ihren strukturbiologischen Untersuchungen verschiedene Verfahren. Neben Kernspinresonanz (NMR)-Spektroskopie, Röntgenkristallographie, Kleinwinkel-Röntgenstreuungsanalysen kamen auch biochemische Experimente zum Einsatz.
So konnten die Autoren nachweisen, wie sich die Struktur der miRNA während deren Reifung verändert und sich weiterentwickelt. Die Wissenschaftler vermuten, dass ihre Erkenntnisse auch auf andere MikroRNAs übertragbar ist. „Langfristig hilft uns das Verständnis für die Prozesse dabei, neue Therapieoptionen – beispielsweise gegen Krebs – zu entwickeln“, so Michael Sattler abschließend.
Weitere Informationen
Original-Publikation:
Kooshapur,H. et al. (2018): Structural basis for terminal loop recognition and stimulation of pri-miRNA-18a processing by hnRNP A1. Nature Communications, DOI: 10.1038/s41467-018-04871-9
Pressemitteilung Helmholtz Zentrum München: Neuer Einblick in die Reifung von miRNAs